- מְחַבֵּר Alex Aldridge [email protected].
- Public 2023-12-17 13:39.
- שונה לאחרונה 2025-06-01 07:36.
ההבדל העיקרי בין תגובות מסדר ראשון ושני הוא שקצב התגובות מסדר ראשון תלוי בחזק הראשון של ריכוז המגיבים במשוואת הקצב ואילו קצב התגובות מסדר שני תלוי בחזק השני של הריכוז מונח במשוואת התעריפים.
סדר התגובה הוא סכום הכוחות שאליהם מועלים ריכוזי המגיבים במשוואת חוק הקצב. ישנן מספר צורות של תגובות לפי הגדרה זו; תגובות מסדר אפס (תגובות אלו אינן תלויות בריכוז המגיבים), תגובות מסדר ראשון ותגובות מסדר שני.
מהן תגובות הזמנה ראשונה?
תגובות מסדר ראשון הן תגובות כימיות שקצב התגובה שלהן תלוי בריכוז המולארי של אחד המגיבים המעורבים בתגובה. לכן, לפי ההגדרה לעיל לסדר התגובה, סכום הכוחות שאליהם מועלים ריכוזי המגיבים במשוואת חוק הקצב יהיה תמיד 1. יכול להיות מגיב בודד שלוקח חלק בתגובות אלו. ואז הריכוז של מגיב זה קובע את קצב התגובה. אבל לפעמים, יש יותר ממגיבים אחד שלוקחים חלק בתגובות האלה, ואז אחד מהמגיבים האלה יקבע את קצב התגובה.
הבה נבחן דוגמה כדי להבין את המושג הזה. בתגובת הפירוק של N2O5, הוא יוצר NO2 ו-O 2 גזים כמוצרים. מכיוון שיש לו רק מגיב אחד, נוכל לכתוב את התגובה ואת משוואת הקצב כדלקמן.
2N2O5(g) → 4NO2(g) + O 2(g)
Rate=k[N2O5(g)]m
כאן k הוא קבוע הקצב לתגובה זו ו-m הוא סדר התגובה. לכן, מקביעות ניסוי, הערך של m הוא 1. לפיכך, זוהי תגובה מסדר ראשון.
מהן תגובות מסדר שני?
תגובות מסדר שני הן תגובות כימיות שקצב התגובה שלהן תלוי בריכוז המולרי של שניים מהמגיבים או בחזקת השנייה של מגיב אחד המעורב בתגובה. לכן, לפי ההגדרה לעיל לסדר התגובה, סכום הכוחות שאליהם מועלים ריכוזי המגיבים במשוואת חוק הקצב יהיה תמיד 2. אם יש שני מגיבים, קצב התגובה יהיה תלוי בחזקת הראשונה של הריכוז של כל מגיב.
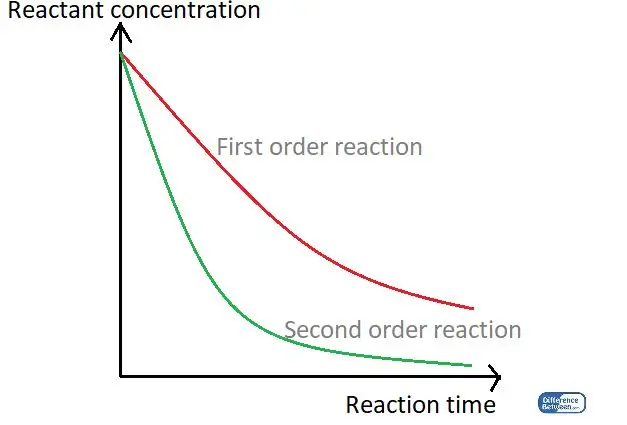
איור 01: גרף המשווה בין שני סוגי סדר התגובה תוך שימוש בזמן התגובה שלהם וריכוז המגיבים.
אם נעלה פי 2 את הריכוז של מגיב (אם יש שני מגיבים במשוואת הקצב), אז קצב התגובה גדל פי 4. לדוגמה, הבה נבחן את התגובה הבאה.
2A → P
כאן A הוא מגיב ו-P הוא המוצר. אז אם זו תגובה מסדר שני, משוואת הקצב עבור תגובה זו היא כדלקמן.
Rate=k[A]2
אבל לתגובה עם שני מגיבים שונים, כגון:
A + B → P
Rate=k[A]1[B]1
מה ההבדל בין תגובות מסדר ראשון לשני?
תגובות מסדר ראשון הן תגובות כימיות שקצב התגובה שלהן תלוי בריכוז המולארי של אחד המגיבים המעורבים בתגובה.לכן, אם נעלה את ריכוז המגיב פי 2, קצב התגובה גדל פי 2. תגובות מסדר שני הן תגובות כימיות שקצב התגובה שלהן תלוי בריכוז המולארי של שניים מהמגיבים או בחזקת השנייה של מגיב אחד המעורב בתגובה. מכאן שאם נעלה את ריכוז המגיב פי 2, קצב התגובה גדל פי 4. האינפוגרפיקה שלהלן מציגה את ההבדל בין תגובות מסדר ראשון ושני בצורה טבלה.

סיכום - תגובות מסדר ראשון מול שני
יש שלושה סוגים עיקריים של תגובות לפי סדר התגובה; תגובות מסדר אפס, מסדר ראשון וסדר שני. ההבדל העיקרי בין תגובות מסדר ראשון לשני הוא שקצב תגובה מסדר ראשון תלוי בחזק הראשון של ריכוז המגיבים במשוואת הקצב ואילו קצב תגובה מסדר שני תלוי בחזק השני של מונח הריכוז ב- משוואת שיעור.






